содержание .. 59 60 61 62 63 64 65 66 67 68 69 70 ..
КОРОТКОУЗЛИЕ ВИНОГРАДА (FANLEAF OF GRAPEVINE)
Синонимы. Инфекционное вырождение винограда [1, 7]; degenerescence infectieuse; court-noue; arricciarnento; ReisigKrank-heit; Gabler; Krautern; curto infeccioso; urticado. Особые штаммы вируса короткоузлия вызывают симптомы недостаточности хлорофилла, обозначаемой специальными названиями: зеленая или "настоящая" мозаика ("true" mosaic); желтая мозаика (yellow mosaic) ; хромовое пожелтение (chrome-yellowing); окаймление жилок (vein banding); мозаика (mosaique); пестролистность (panachure); giallume; Mosaik; Gelbmosaik; Panaschure; mosaico amarelo.
История и географическое распространение. О симптомах, связанных с короткоузлием винограда, много лет назад упоминалось во французской, итальянской, немецкой и австрийской литературе ,[242].
Наличие на винограде очагов вируса наряду с присутствием нематоды-переносчика(Xiphinema index Thome et Allen) в местных виноградниках стран Восточного Средиземноморья (Греции [280]) 1И Западной Азии (Турции, Ирана [30, 320]) показывает, что болезнь могла существовать в этих зонах с первых лет культуры винограда. Вместе с вегетативно размноженным посадочным материалом короткоузлие и, вероятно, нематода-переносчик вируса распространились из Европы практически во все области мира, где сейчас выращивают виноград: Калифорнию, Центральную и Южную Америку, Южную Африку и Австралию. Завоз филлоксеры винограда в большинство европейских виноградников явился косвенной причиной широкого распространения короткоузлия, так же как и других вирусных болезней винограда. Этому способствовали изменения приемов культуры (прививка на гибридные подвои, расширенный обмен посадочным материалом и повторные пересадки виноградников, особенно в самых известных странах виноградарства).
В американских зонах выращивания Vitis labrusca (северо-восток США и прилегающие районы Канады), несмотря на частую встречаемость симптомов мозаики и деформаций листьев на некоторых сортах, вирус короткоузлия ни разу не был выделен из них (Диас, личное сообщение, 1965).
Отсутствуют также сообщения о нахождении вируса короткоузлия в диких популяциях североамериканских видов Vitis. Нет никаких сведений относительно Vitis в Северной и Восточной Азии.
Экономическое значение. В суровых условиях окружающей среды (маломощные почвы, жаркий и солнечный климат) короткоузлие и близкие к. нему болезни могут убивать кусты винограда. Однако пораженные лозы обычно еще долгое время остаются живыми, становясь все менее и менее продуктивными, пока наконец зараженные виноградники не забрасываются из экономических соображений. Продуктивность кустов, пораженных короткоузлием, снижается до степени, которая определяется условиями погоды в период цветения. В евоопейских странах для наиболее восприимчивых сортов Vitiы vinifera, например Шардонне, Мускат и Таминер, снижение состав^, ляет в среднем 50% от веса урожая. Кроме того, товарная ценность, столовых сортов винограда заметно падает из-за внешнего вида гроздей (осыпание и торошение ягод) с пораженных кустов. В питомниках черенки или растения, привитые черенками, древесина которых была поражена короткоузлием, отличаются более слабым ростом и пониженной способностью к окоренению; процент успешных прививок снижается.
Круг растений-хозяев. а) Древесные растения-хозяева. Все сорта V. vinifera восприимчивы; не известно ни одного устойчивого или толерантного сорта, хотя некоторые сорта поражаются слабее других.
Установлено, что все американские виды, интродуцированные в Европу, и гибриды V. labrusca, V. riparia, V. rupestris, V. berlan-dieri, V. aestivalis и V. candicans восприимчивы к вирусу короткоузлия при естественном заражении (выращивание в почве, зараженной нематодами [42], и при экспериментальной инокуляции прививкой [310]).
Декоративные азиатские виды V. davidi, V. coignetiae, V. piasez-kii, V. ishikari и плодоносные сорта V. amurensis можно легко заразить прививкой [310].
В Португалии виды Ampelopsis и Parthenocissus были экспериментально заражены вирусами короткоузлия и желтой мозаики [97]. Во Франции мозаику и желтую пестролистность, отмеченные на декоративном виде Cissus и диком винограде (Parthenocissus quinquefolia), не удалось связать с вирусом короткоузлия. (Попытки инокулировать прививкой виды Vitis успеха не имели, так же как и опыты по механической инокуляции некоторых травянистых хозяев.)
Некоторые работники указывают, что многие древесные многолетники (деревья и декоративные кустарники, например Ligustrum, Prunus, Jiiglans, Ulmus, Acer и др.) являются возможными хозяевами вируса' [10, 12, 80, 85], но это требуется доказать, выделив вирус короткоузлия из этих инокулированных им видов и снова заразив им виноград или травянистых хозяев.
б) Травянистые хозяева. Несколько травянистых растений можно экспериментально заразить вирусом короткоузлия, применив механическую инокуляцию, но в отличие от опытов с другими передающимися через почву вирусами кольцевой пятнистости ни в одном случае не удалось обнаружить естественного заражения их в полевых условиях. Некоторым сильно восприимчивым видам, например Chenopodium quinoa, С. amaranticolor, С. polyspermum ив меньшей степени Gomphrena globosa, и некоторым видам Аmаranthus можно легко передать вирус от винограда путем механической инокуляции. Вирус короткоузлия можно последовательно механически передавать от этих видов широкому кругу других видов растений [98]; некоторые из них заражаются с трудом, что зависит от отдельных штаммов вируса и от сезонных условий окружающей среды, или заражение возможно только на инокулированных листьях. В приведенном ниже списке эти виды заключены в скобки.
Chenopodiaceae: Chenopodium quinoa Wil.ld., С. amaranticolor Coste et Reyn., С polvspermum L., C. urbicum L., C. album L., C. hybridum L., C. murale L, С rubrum L., C. foetidum Schrad., C. ambrosioides L.t C. anthelminticum L., C. botrus L С vulvaria L., C. foliosum Asch., C. capitatum (L.) Asch., (C. bonus-henn-cus L"), (C. multifidum L.), (Atriplex hastata L.), (Beta vulgaris L.).
Amaranthaceae: Gomphrena globosa L., Amaranthus patulus Fion, A. panicula-tus L., A. spinosus L., A. caudatus L., (A retroflexus L.), (Celosia plumosa L.).
Cucurbitaceae: Cucumis sativus L., (C. melo L.).
Leguminosae: Phaseolus vulgaris L., (Vigna sinensis i[TornerJ Savi).
Solanaceae- Nicotina clevelandii Gray. (N. tabacum L., сорта Самсун Уайт БарлейиКсанти), (N. rustica L.), (N. debney Domin) (N. affins Hort.= N bigelovii [Torr.] Wats. var. multiualvis Lindl.), (N. digluta Hort.= N. glutitnosa L X N. tabacum L.), (N. glauca Grhm.), (N. glutinosa L.), (Petunia hybnda Vilm.).
Другие указанные в литературе виды [10], для которых идентичность перенесенного вируса точно не установлена, требуют дальнейшего подтверждения. В их число входят:
Umbelliferae: Ammi majus L.
Balsaminaeeae: Impatiens holstani Hort (I. holstu Engler et Warb. X I. sultani Hook.).
Leguminosae: Medicago sativa L.
Solanaceae: Lycopersicum esculentum Mill., L. pimpmelhfohum Dunal, Datura stramonium L.
Симптомы. а) Симптомы на листьях. Короткоузлие вызывает характерную деформацию листьев, при которой жилки ненормально, расходятся веером (рис. 107). У некоторых сортов Vitis yintfera, например Мисьон (Калифорния), Шардонне (Франция), Витал (Италия), гибрид SF4 (ФРГ), Фернао Пирес (Португалия), а также у американских видов и гибридов V. rupestns и V. vulpina (ripariq); этот симптом заметен очень ясно. Но у многих сортов винограда такие деформации никогда не возникают и наблюдается только слабая асимметрия и уменьшение размера листьев.

Рис 107. Слева - деформированный лист сорта Шардонне (Vitis vinifera).
Вверху справа - частично пораженный куст: один побег почти нормален.
Внизу справа - общее заражение сильным штаммом вируса короткоузлия (Мерсо,
Золотой Берег)
Симптомы короткоузлия появляются только в хронической ста дни болезни (вторичный симптом). Первичные симптомы на недавно зараженных кустах винограда представлены кольцевым и линейным узорами и маслянистыми пятнами на некоторых листьях (рис 108 вверху). Эти симптомы мимолетны и быстро уступают место системной зеленой или желтой мозаике (иногда в сочетании с окаймлением жилок), что может быть связано с различными степенями деформации (рис. 108, внизу).
Как и при деформациях листьев, степень выраженности симптомов мозаики различается в зависимости от штамма вируса, участвующего в заражении; иногда симптомы могут совершенно отсутствовать. Кроме того, кусты винограда с симптомами мозаики и симптомами, напоминающими короткоузлие не обязательно бывают заражены вирусом короткоузлия, как это будет показано ниже [165, 323].

Рис. 108. Вверху - первичные симптомы короткоузлия на гибриде Кобер
5ВВ (berlandieri x riparia), вызванные естественной почвенной
инфекцией: слева - кольцевой и линейный узоры; справа - маслянистые
пятна и кольцевая пятнистость. Внизу слева - сорт Шардонне (Vitis
vinifera) с симптомами зеленой и желтой мозаики, но без деформации
листьев; справа - тот же сорт с симптомами желтого окаймления жилок,
связанного с короткоузлием (Кольмар, Верхний Рейн; Мерсо, Золотой
Берег)

Рис. 109. Слева - плодовая кисть сорта Меслие с симптомами
торошения. Справа вверху - влияние короткоузлия на продуктивность
винограда: слева - урожай с зараженного куста сорта Шардонне; справа
- виноград, собранный со здорового куста. Внизу справа - трабекулы в
ксилемном сосуде побега сорта Кобер 5ВВ (berlandieri x riparia),
зараженного короткоузлием (Кольмар, Верхний Рейн)
б) Симптомы на штамбе. У побегов на виноградных кустах пораженных короткоузлием, междоузлия короче и более неровные чем у здоровых. Усиленное развитие боковых побегов придает лозам кустистый вид. Двойные узлы и фасциации штамбов гроздей усов и черешков традиционно считаются наиболее яркими симптомами короткоузлия. Однако диагноз, основанный на этих признаках, не может считаться надежным, поскольку разбросанные двойные узлы или фасциации можно нередко наблюдать на кустах, которые долгое время растут и плодоносят нормально и при испытаниях на индикаторных сортах винограда или травянистых тест-растениях не обнаруживают заражения вирусом короткоузлия [28, 308].
в) Симптомы на плодах. Для практики самым важным симптомом короткоузлия, проявляющимся на кистях, является осыпание ягод или торошение (рис. 109). Даже очень сильные симптомы поражения ягод могут проявляться без серьезного нарушения для роста кустов или в отсутствие явных симптомов на листьях. Однако осыпание и торошение ягод отнюдь не специфичные симптомы, так как они могут появляться и при других вирусных болезнях, например при пожелтении жилок винограда, и при определенных климатических или генетических условиях: так, торошение обычно наблюдается на женских сортах Vitis vinifera.
г) Внутренние симптомы. Эндрцеллюлярные кордоны (cordoni endocellulari) Петри [218, 219], или трабекулы, представляют собой особые продукты клеточной мембраны, развивающиеся в тканях кустов, пораженных короткоузлием. Трабекулы легко обнаружить в сосудах одревесневших побегов, где они образуют стекловидные, светопреломляющие радиальные тяжи (рис. 109, внизу справа).
Образование трабекул часто связывали с инфекционным вырождением виноградной лозы (короткоузлие и желтая мозаика) [25, 178, 250, 251], хотя небольшое число трабекул еще не является достаточным доказательством заражения. Опыты с прививками показали, что у одних видов винограда (Vitis riparia, V. rupestris, V. berlandieri и их гибриды) трабекулы встречаются в большем количестве, чем у других (V. vinifera, V. labrusca) [305, 307].
Специфичность трабекул как диагностического признака корот-коузлия требует дальнейшего обсуждения, поскольку они были обнаружены также при инфекционном некрозе винограда в Чехословакии [108] и при скручивании листьев американского винограда в Калифорнии [172]. Результаты наших опытов с прививками не совпадают с данными последней работы, поскольку трабекулы развивались в больших количествах в стеблях гибрида Кобер 5ВВ (berlandieriy х riparia), индикатора, инокулированного вирусом короткоузлия, но отсутствовали при инокуляции европейским штаммом скручивания листьев [314].
д) Симптомы на индикаторных видах винограда. После инокуляции прививкой сорта Сент-Джордж (Vitis rupestris) вирусом короткоузлия на растениях появляются маслянистые пятна, мозаика и асимметричные листья. Позднее системно зараженные растения характеризуются листьями с'сильно зазубренными краями, приобретают кустистую форму и прекращают рост. В стеблях имеются многочисленные трабекулы.
По данным калифорнийских исследователей [160, 166], в течение первого года V. rupestris является хорошим индикатором, так как дает ясно различимые реакции на короткоузлие и другие вирусные болезни винограда: вирус звездчатой мозаики вызывает образование желтых полос вдоль главных жилок, тогда как вирус пожелтения жилок винограда реакции вообще не дает (V. rupestris к числу хозяев этого вируса не относится). Во Франции мозаичная болезнь, не связанная с короткоузлием, вызывает у V. rupestris скручивание листьев и межжилковую крапчатость, причем симптомы в этих случаях развиваются во времени позднее, чем симптомы короткоузлия [325]. Образования трабекул болезнь не вызывает.
е) Симптомы на травянистых хозяевах. Описание симптомов, вызываемых вирусом короткоузлия, на отдельных видах травянистых хозяев следует искать в оригинальных работах. Они настолько изменчивы, что здесь их суммировать трудно, так как в разных странах они различаются в зависимости от штаммов вируса, вида тест-растения и условий окружающей среды. Здесь суммированы результаты работ автора с французскими изолятами вируса короткоузлия.

Рис. 110. Слева вверху - посветление жилок на новых листьях
Chenopodium quinoa, появившееся через 10 дней после механической
инокуляции вирусом короткоузлия. Слева в середине - тот же вид через
25 дней после инокуляции; интенсивность проявления симптомов
различается в зависимости от отдельных штаммов вируса: 'нормальный'
штамм, допускающий почти полное выздоровление растений (слева);
'сильный' штамм F13, вызывающий устойчивую мозаику и деформацию
листьев (справа). Слева внизу - системные симптомы Chenopodium
amaranticotor через 15 дней после инокуляции. Справа вверху -
Gomphrena globosa, сорт Пурпур Тезье, с локальными поражениями на
инокулированных листьях. Справа внизу - тот же вид: листья скручены
в результате системного заражения
Chenopodium quinoa. Местные поражения на инокулированных листьях заметны только при использовании некоторых вирулентных изолятов [331]. Большинство штаммов не вызывает местных поражений, которые можно было бы использовать для количественных исследований. Системные симптомы выражаются в посветлении жилок на молодых листьях, образовавшихся через 8 или 10 дней после инокуляции (рис. 110, вверху слева); через 15 - 20 дней симптомы постепенно ослабевают и совершенно исчезают, кроме тех случаев, когда в опытах используются более сильные штаммы, вызывающие стойкую деформацию листьев [331]. В летнее время симптомы быстро маскируются, и в конце осени посветление жилок уже не наблюдается, а отмечаются только эпинастия молодых листьев и "белая" окраска верхушек (рис. 110, средний слева).
Chenopodium amaranticolor реагирует таким же образом, но более медленно, чем С. quinoa (рис. 110, внизу слева). Для развития системной мозаики требуется 15 - 17 дней.
Gomphrena globosa. На инокулированных листьях сорта Пурпур Тезье иногда возникают темно-лиловые пятна неправильной формы (рис. 110, вверху справа). Затем, когда растения становятся системно зараженными, на небольшом числе листьев появляются мозаика и скручивание (рис. 110, внизу справа), но с точки зрения выраженности симптомов этот вид является плохим индикатором вируса короткоузлия, за исключением его вирулентных штаммов. Главным достоинством данного тест-растения является его способность дифференцировать вирус корот-коузлия от вируса мозаики резухи (типичные штаммы вируса мозаики резухи из Великобритании вызывают местные поражения на инокулированных листьях, но не системную инфекцию). Таким образом, этот хозяин позволяет резделить короткоузлие (системное заражение) от мозаики резухи (только местные поражения). Другое дифференцирующее растение Tetragonia expansa (новозеландский шпинат) также отделяет мозаику резухи (системная инфекция) от короткоузлия (невосприимчивость). Однако последние исследования, проведенные на "промежуточных" изолятах вируса из винограда, серологически очень близких к вирусу мозаики резухи, но практически неотличимых от вируса короткоузлия по кругу травянистых хозяев и симптомам [328], вероятно, уничтожат всякие шансы на дифференциацию двух явно различных серотипов: мозаики резухи и короткоузлия винограда на основании реакций указанных тест-растений.
Cucumis sativus, сорт Корнишон Зеленый Парижский. Некоторые изоляты вируса короткоузлия вызывают светло-зеленые местные поражения на инокулированных семядолях (рис. 111, вверху слева). Затем через 15 - 20 дней различное число растений становится системно зараженными и на них появляется мозаика с многочисленными светло-зелеными пятнами, а иногда сильно деформированные листья (рис. 111, вверху справа).
Phaseolus vulgar is, сорта Процессор или Принц. Местные поражения на инокулированных первых листьях отсутствуют или появляются очень редко (в зимних условиях). Системные симптомы кольцевой пятнистости или мозаики развиваются на некоторых тройчатых листьях через 15 - 30 дней (рис. 111, внизу).
Виды Nicotiana (табак). С точки зрения симптоматологии эти хозяева мало пригодны для вируса короткоузлия. Вирус можно было выделить из инокулированных листьев, но заразить системно удалось только N. clevelandii. В наших исследованиях мы никогда не наблюдали на растениях Nicotiana кольцевые и линейные узоры, о которых упоминают некоторые исследователи.

Рис. 111. Вверху слева - сеянцы огурца (сорт Корнишон Зеленый
Парижский): видны местные поражения на инокулированных семядолях.
Вверху справа - симптомы системного поражения плети того же сорта.
Внизу - молодые тройчатые листья фасоли сорта Процессор, пораженные
кольцевой пятнистостью (слева) и мозаикой (справа)
Комплексные инфекции. а) В растениях винограда. В растениях винограда могут присутствовать одновременно различные вирусы, но не доказано формирование "комплексных инфекций" в смысле изменения симптоматологии или синергизма. Нередко вирусы короткоузлия и скручивания листьев заражают одно и то же растение, оказывая аддитивный эффект в отношении симптомов, роста и урожая. И даже экспериментально доказано, что одно и то же растение винограда может нести в себе различные штаммы вируса короткоузлия: 1) среди вегетативного потомства растений, зараженных короткоузлием, попадаются иногда экземпляры, пораженные желтой мозаикой, или, наоборот, материнские растения, зараженные желтой мозаикой, дают некоторое число растений, пораженных только "зеленым короткоузлием"; 2) растения, зараженные короткоузлием, кроме того, можно заразить желтой мозаикой с помощью прививки или естественным путем через почву [97, 317].
Недавно было доказано, что некоторые вирусы кольцевой пятнистости, например черной кольцевой пятнистости томатов в ФРГ "19], так же как и мозаики резухи в ФРГ и, возможно, во Франции 331], могут иногда объединяться с короткоузлием, но еще не установлено, присутствуют ли эти вирусы как случайные латентные загрязнители или же играют какую-либо роль в болезни, наблюдаемой у зараженных растений. Необходимо также выяснить точно долю участия вируса короткоузлия в появлении на листьях особых симптомов, носящих в некоторых странах такие названия, как листовидные выросты на нижней поверхности листьев (enation) в Италии и ФРГ [132, 148] и legno riccio или "ямчатость штамба" и "некроз побегов" в Италии [148, 197].
В Венгрии из некоторых кустов с симптомами желтой мозаики и короткоузлия недавно выделили вирус, не связанный с короткоузлием [194]. Для выяснения вопроса о том, широко ли распространен этот новый вирус в Венгрии или он является только случайным загрязнителем кустов, уже зараженных короткоузлием, требуются дальнейшие исследования.
б) В травянистых хозяевах. Симптомы иногда изменяются в течение ряда последовательных передач путем механической инокуляции изолятов вируса короткоузлия травянистым хозяевам. Этот факт соответствует гипотезе о смешанных заражениях одного и того же растения более чем одним вирусом. Однако в растениях Chenopodium amaranticolor [101] и С. quinoa [329, 331] было совершенно ясно показано существование перекрестного иммунитета между штаммами вируса короткоузлия. При системном заражении определенным штаммом вируса короткоузлия эти растения становятся уже невосприимчивыми к механической субинокуляции другим, более вирулентным штаммом того же вируса. Однако они сохраняют восприимчивость к контрольной инокуляции другими, неродственными вирусами кольцевой пятнистости (черной кольцевой пятнистости томата, кольцевой пятнистости малины и кольцевой пятнистости томата) и даже к вирусу мозаики резухи, который близок к вирусу короткоузлия. В этом случае инкубационный период длится немного дольше, чем обычно [101].
Возбудитель. Свойства, присущие инфекционному вырождению винограда, приводят к сравнению его возбудителя с передающимися через почву вирусами кольцевой пятнистости, поражающими персик, вишню и малину [313]. И, действительно, было обнаружено, что кусты винограда, зараженные короткоузлием и желтой мозаикой, содержат такой вирус кольцевой пятнистости, выделенный впервые Кадменом и др. [54] путем механической инокуляции травянистых растений-хозяев. Многие исследователи выделяли тот же вирус из виноградных кустов, пораженных короткоузлием или желтой мозаикой в большинстве стран мира. Было показано, что вирус содержится в экстрактах из виноградных лоз [321, 330] и его можно передать обратно винограду, вызвав у него симптомы короткоузлия и желтой мозаики [102, 192, 276]. Несомненно, что выделенный вирус кольцевой пятнистости является возбудителем болезни.
Свойства вируса короткоузлия были определены сначала в соке травянистых растений, а затем в экстрактах тканей винограда.
а) Предельное разведение. Опубликованные данные сильно различаются между собой и колеблются от 1 :500 до 1 : 50000 [192]. Такие колебания можно проследить вплоть до различий в скорости размножения отдельных штаммов из разных стран. По определениям автора, для французских штаммов вируса короткоузлия предельное разведение сока Chenopodium quinoa составляло от 1 : 1000 до 1 :2000.
б) Температура инактивации. Температура, при которой сок через 10 мин. теряет инфекционность, также сильно варьирует для отдельных штаммов вируса короткоузлия и колеблется от 55 - 56 до 62 - 64°С [192]. Наши определения показали, что для французских штаммов в соке С. quinoa температура инактивации составила 55 - 56°С [321, 322]; эта температура наиболее близка к данным Брюкбауэра и Рюделя [48 - 50].
в) Долговечность in vitro. Инфекционность сохраняется в пределах от нескольких недель при 18 - 20°С до нескольких месяцев в замороженном состоянии при -20°С. По нашим определениям, при 4°С она сохранялась в забуференном соке С. quinoa 34 дня, но не в течение 64 дней, и в экстрактах из листьев винограда, содержащих никотин,- свыше 4 дней [321]. При -15°Сминфек-ционность можно сохранять в течение нескольких месяцев не только в экстрактах С. quinoa, но и в экстрактах из листьев винограда, содержащих никотин [321]. Однако замораживание образцов может вызвать снижение инфекционности и некоторые качественные изменения симптоматологии штаммов. Антигенность замороженных образцов может сохраняться значительно дольше, чем инфекционность (в течение года и дольше) [328].
г) Очистка. Вирус короткоузлия можно осадить из инфекционного сока с помощью химикатов [98 - 100], например 30%-ным насыщенным сульфатом аммония, 30 - 40%-ным ацетоном или этанолом, предпочтительно вблизи изоэлектрической точки вируса (рН5). Согласно нашим данным, при подобных методах очистки теряется большое количество вируса. Для очистки вируса короткоузлия, выделенного из травянистых хозяев, чаще всего применяются различные модификации метода Стара, разработанного для вируса кольцевой пятнистости табака (эмульгирование сока в смеси бутанола с хлороформом и несколько циклов центрифугирования при высоком и малом числе оборотов) [101]. Но сохраняющиеся нуклео-протеины хозяина, загрязняющие вирус, можно удалить только центрифугированием в градиенте плотности сахарозы [192] или электрофорезом [291].
Иммунные сыворотки к вирусу короткоузлия можно использовать также в качестве специфических агентов преципитации вируса из сока травянистого хозяина, а также из экстрактов растений винограда [330]. При исследовании преципитатов антиген-антитело под электронным микроскопом видно, что они образуются из агрегированных вирусных частиц. Преципитаты, содержащие вирус короткоузлия, очень легко изолировать в агаровом геле [326] по методу Аллена и Тремена [3], разработанному для выделения вируса некротической кольцевой пятнистости Prunus.
д) Форма и величина вируса. Очищенные препараты, отличающиеся высокой инфекционностью, содержат многочисленные полиэдрические частицы, сходные с частицами других вирусов, вызывающих кольцевую пятнистость. В напыленных препаратах их диаметр равен 25 - 30 ммк [54, 192], а в фосфорно-вольфрамовых - 22 ммк [322]. Подобные частицы обнаружены не только в травянистых хозяевах, но и в экстрактах из виноградных листьев, в которых вирус короткоузлия был осажден приготовленной к нему иммунной сывороткой [330].
е) Серология. Инъекция кроликам концентрированных препаратов вируса короткоузлия вызывает образование специфических антител. Титр иммунных сывороток обычно достигает 1 : 512 - 1 : 1028 при испытании против штаммов вируса короткоузлия. При использовании метода иммунодиффузии в геле все штаммы вируса короткоузлия реагировали с антисыворотками к вирусу короткоузлия без каких-либо признаков "перекреста" или образования "шпоры". Следовательно, все они были очень близки между собой. Некоторые антисыворотки к вирусу короткоузлия в разведениях до 1:16 или даже 1 : 64 реагируют также с вирусом мозаики резухи, и, наоборот, антисыворотки к вирусу мозаики резухи в разведении до 1 : 64 - 1 : 125 реагируют с некоторыми изолятами, выделенными из больных растений винограда.
Эти результаты требуют обсуждения, поскольку такие перекрестные реакции не всегда удается легко получать [19, 331], даже используя неразведенную антисыворотку с высоким титром и варьируя разведения антигена, чтобы избежать возможной маскировки реакции в результате "зонального феномена" [203].
Выделение из больных кустов винограда вирусов мозаики резухи и короткоузлия [19] может подтверждать мысль о том, что полученные в прошлом некоторые изоляты фактически представляли собой смеси вирусов короткоузлия и мозаики резухи. Однако было бы наивно заключать на этом основании, что наблюдавшиеся перекрестные реакции в каждом случае вызывались смешанными изолятами обоих вирусов. В действительности вирусам короткоузлия и мозаики резухи свойственна частичная идентичность перекрестно-серологических взаимосвязей, которая становится заметной при проведении иммунодиффузионных тестов по Охтерлони [211]. Линии преципитации, соответствующие вирусам короткоузлия и мозаики резухи, образуют шпоры, но никогда не дают перекрестов, которые наблюдаются при использовании смесей неродственных вирусов. Однако соответственные количества общих антигенных детерминантов обоих вирусов, вероятно, могут варьировать от высоких до низких и практически до полного отсутствия в зависимости от отдельных штаммов вирусов короткоузлия и мозаики резухи. Подобная гипотеза может объяснить большую часть приводимых в литературе наблюдений, которые противоречат предшествующему выводу: вирусы мозаики резухи и короткоузлия винограда различаются по многим биологическим свойствам, но относятся к одному и тому же серотипу [101].
Дифференциальный диагноз короткоузлия в случае смешанной инфекции с вирусом мозаики резухи возможен с помощью серологии при использовании умеренно разведенной (примерно 1 : 50) антисыворотки, когда количество гетерологичных антител становится крайне незначительным.
При помощи серологии можно также обнаружить бессимптомные зараженные растения среди инокулированных травянистых хозяев или виноградных лоз, отобранных для размножения. В ряде случаев для серологических тестов можно использовать осветленный сок соответствующих хозяев, например Nicotiana clevelandii [101]. Однако более часто концентрация вируса слишком низкая и не вызывает заметных реакций преципитации, если только антиген не концентрируют искусственными методами. При работе с виноградом обычно отбирают для каждого образца по 10 молодых листьев, предпочтительно весной (когда концентрация вируса короткоузлия достигает максимума), и гомогенизируют их в 40 мл воды (или фосфатного буфера), содержащих 2,5% никотина. После осветления экстракты ультрацентрифугируют (Спинко Ротор 30) в течение 2,5 ч при 105000 X g. Надосадочную жидкость отбрасывают, а осадки, содержащие все присутствующие вирусы, повторно суспендируют в 1 мл воды. Такие экстракты очень грубы, но их вполне можно испытывать по Охтерлони серологическим методом диффузионной преципитации в геле: обычно реакции каждого отдельного образца с целой шкалой разведений антисыворотки к вирусу короткоузлия испытываются в сравнении с контрольным экстрактом, содержащим частично очищенный вирус короткоузлия [211].
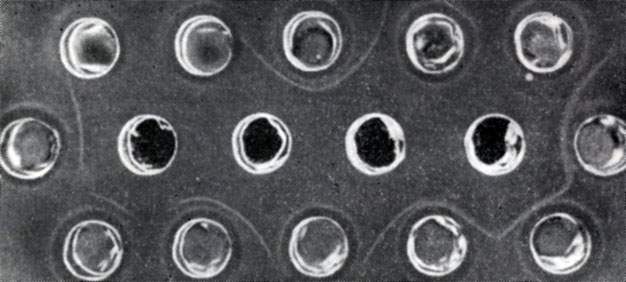
Рис. 112. Серологическая реакция иммунодиффузии в геле по Охтерлони
между сывороткой, иммунной к короткоузлию (центральные лунки), и
концентрированными экстрактами листьев винограда (периферические
лунки). Специфические линии преципитации окружают лунки, содержащие
вирус короткоузлия
Характерная линия преципитации образуется в зоне, где антигены и антитела встречаются в оптимальных соотношениях, и вполне совпадает с линией, соответствующей лункам, заполненным частично очищенным вирусом (контроль). Таким образом, исключается возможность путаницы с линиями, не специфичными для вируса, но соответствующими белкам растения-хозяина (рис. 112).
Передача зараженной древесиной. Короткоузлие легко передается при вегетативном размножении зараженных растений (через черенки, подвои или привои). Кроме того, если здоровые привои прививают на зараженные подвои или наоборот, то через несколько месяцев после срастания все растение оказывается зараженным вирусом. Такой зараженный материал вносит короткоузлие в новые виноградники. Следовательно, главным фактором распространения болезни является человек.
Передача прививкой применяется для диагноза болезни путем индексирования на соответствующих индикаторных сортах винограда.
Передача механической инокуляцией. а) От винограда винограду. В природе механическая инокуляция вируса короткоузлия вряд ли происходит; в литературе описан единственный случай передачи мозаики "melnik" (возможно, родственной короткоузлию) в северной Чехословакии [271, 272].
б) От винограда травянистому хозяину. Для механической передачи вируса короткоузлия от винограда травянистому хозяину Кадмен и др. [54] использовали никотин. Это вещество, которое Корнюэ и др. [84] впервые использовали в работе с вирусами георгины, по-прежнему остается очень ценным средством сохранения вируса в соке растений, содержащих танины. В отношении вируса короткоузлия также применялись фосфатный буфер, углекислый натрий и окись алюминия, но с меньшим успехом, чем никотин.
в) От травянистого хозяина травянистому хозяину. Вирус короткоузлия можно обычно очень легко передать механически, но если его нужно передать целому ряду различных видов хозяев, то инокулюм необходимо применять в умеренном разведении, чтобы ослабить активность ингибиторов. Промежуточным хозяином, пригодным для приготовления инокулюмов, считается Gomphrena globosa, содержащая минимум ингибиторов [98].
г) От тест-растений винограду. Известно несколько случаев, когда в результате простого контакта тканей без срастания прививок вирус короткоузлия передавался от Chenopodium amaranticolor винограду [100]. В других опытах Хьюитт и Кори [162], Мартелли и Хьюитт [192], Тейлор и Хьюитт [276] передавали вирус винограду путем механической инокуляции. Сначала выращивали этиолированные сеянцы или черенки сортов Мисьон (Vitis uinifera) .или Сент-Джордж (V. rapestris} для этого их содержали в темных помещениях, ежечасно освещая в течение только 3 мин. Для инокуляции листья предварительно опыливали корундом, а затем натирали суспензией очищенного вируса короткоузлия, выделенного из травянистых растений-хозяев. Через три или четыре недели на инокулированных листьях появлялись маслянистые пятна, а позднее на вновь развивающихся листьях - системная мозаика; некоторые растения погибли (некроз верхушек). Из инокулированных растений винограда был снова выделен вирус короткоузлия.
Передача через живых переносчиков. Как и другие вирусы, вызывающие кольцевую пятнистость, вирус короткоузлия винограда не передается через насекомых. Попытки передать его через тлю Муzus persicae (Sulz.) травянистым растениям [100] и через Phylloxera radicicola - винограду [170, 210, 311] оказались безуспешными. В природных условиях инсектициды, внесенные в почву, зараженную короткоузлием, не оказывали влияния на инфекционность.
Только фумиганты-нематоциды воздействуют на передачу вируса короткоузлия [311 - 313, 315, 318]. Опыты Хьюитта и др. [170] впервые показали, что переносчиками вируса короткоузлия являются обитающие в почве нематоды. Нематода Xiphinema index считается единственным естественным переносчиком короткоузлия. Раньше предполагалось, что такую же роль играет Criconemoides хеnорlax, но для Калифорнии это не подтвердилось. По-видимому, в Европе существует такое же положение: только в опытах с X. index были получены положительные результаты [260, 329].
Ниже описывается методика опытов по передаче вирусов нематодами.
В сосуды со стерилизованной почвой, содержащие по одному здоровому и одному больному растению, служащему источником вируса, вносят специально отобранных нематод подозреваемого вида; в другие сосуды (контроль) нематод не вносят; вирус передается лишь в том случае, если вносимый вид является переносчиком. Другие опыты можно проводить в сосудах, содержащих только здоровые растения, куда помещают специально отобранных нематод, питавшихся предварительно на корнях больных виноградных лоз. Процент передачи можно определить, подсчитав зараженные растения. Однако до начала появления симптомов заболевания на листьях зараженных кустов может пройти несколько лет. Более быстрый метод заключается в выделении вируса путем механической инокуляции травянистых тест-растений (Chenopodium quinoa) экстрактами из кончиков корешков, на которых питались инфекционные Xiphinema index [274, 329]. По данным американских исследователей, вирус короткоузлия можно выделить даже путем механической инокуляции травянистых хозяев небольшими кусочками нематод, разрезанных в капле воды. С помощью таких опытов было установлено, что X. index может воспринять вирус короткоузлия за один день или за меньший срок; вирус сохраняется в них не меньше 90 дней, если нематоды голодают, и всего 7 дней, если они питаются на растениях, невосприимчивых к вирусу. Вирус могут передавать взрослые нематоды и личинки всех возрастов. Однако личинки, питавшиеся на зараженных растениях, после линьки становятся неинфекционными. Молодые личинки, отродившиеся из яиц, отложенных самками, питавшимися на зараженных растениях, не инфекционны (трансовариально инфекция не передается) [229, 230, 274J.
Распространение в естественных условиях. В некоторых странах единственным переносчиком вируса короткоузлия является человек. В этом случае пораженные растения беспорядочно распространяются в результате посадок и прививок.
Во многих зонах виноградарства характер распространения зараженных растений в старых виноградниках бывает совершенно иным, и это показывает, что короткоузлие и желтая мозаика распространяются по типу эпифитотий. Пораженные растения образуют регулярные группы, занимающие один или несколько участков более или менее круглой формы. Число пораженных растений год от года увеличивается. Изучение распространения короткоузлия в природе дало следующие результаты: а) характер распространения исключает возможность передачи болезни любым надземным (летающим) переносчиком; б) безрезультатность обработки почвы высокими дюзами инсектицидов или фунгицидов исключает возможность того, что переносчиком являются почвообитающие насекомые [312]; в) инфекционность почвы исчезает после обработки ее высокими дозами таких фумигантов, как препарат ДД (дихлорпропен-дихлорпропан), бромистый метил, дибромэтилен, хлорпикрин* и сероуглерод** [311, 312, 318].
*(В СССР применение хлорпикрина для почвенной фумигации разрешено с ограничениями. - Ред.)
**(В СССР не применяется. - Ред.)
В вегетационных сосудах и полевых опытах постоянно отмечалась корреляция между присутствием Xiphinema index в почве и зараженностью приманочных растений короткоузлием [4, 181, 260, 329]. Но пытаться предсказывать возможность распространения короткоузлия на основании численности X. index в пробах полевой почвы безусловно рискованно, особенно в северных виноградниках, расположенных в зоне суровых зимних морозов, которые сильно снижают численность популяций нематод.
Меры борьбы. а) В более старых зараженных виноградниках. Обильное удобрение почвы повышает мощность пораженных кустов и в течение некоторого времени поддерживает их продуктивность на приемлемом уровне. Поскольку при повреждениях корневой системы и сильной обрезке симптомы усиливаются, следует избегать глубокой культивации почвы и применять более слабую обрезку.
б) В новых виноградниках. Для закладки новых виноградников требуется посадочный материал, свободный от вирусов; рекомендуется использовать сертифицированные растения. Очень важные и специальные меры борьбы с короткоузлием должны предусматривать возможную зараженность почвы. Для полного очищения почвы от вируса рекомендуется держать почву под паром в течение 10 лет, но и более короткие периоды парования обеспечивают заметное снижение зараженности. Всюду, где длительное парование неприменимо по экономическим причинам, особенно в наиболее ценных районах виноградарства, после выкорчевки старых зараженных виноградников необходимо провести фумигацию почвы перед новыми посадками.
Внесение препарата ДД из расчета 1120 кг/га или эквивалентной дозы других нематоцидов обычно достаточно надежно предупреждают повторные заражения короткоузлием и обеспечивают значительное повышение урожаев новых плантаций. Однако для получения таких результатов на глубоких почвах требуется применять очень высокие дозы фумигантов.
Терапия. Обработка древесины, находящейся в покое (черенки, прививочная древесина), горячей водой (55°С) в течение 5 мин не освобождает растения винограда от вируса короткоузлия. Однако вегетирующие растения реагируют на тепловую терапию. Бови [34] первый применил в отношении лоз, зараженных короткоузлием, воздействие температурой 37 - 38°С в течение нескольких недель. Удалить вирус ему не удалось, но симптомы были на некоторое время ослаблены. Усовершенствование термических методов лечения винограда, достигнутое в Америке и Европе на лозах, выращенных в сосудах или на искусственных питательных средах in vitro, обусловило высокий процент освобождения обработанных лоз от вируса короткоузлия, а иногда и полное их освобождение от него [122 - 125, 134, 138].
Обнаружение и идентификация. Обычно можно очень легко отличить короткоузлие от различных нарушений и расстройств, обусловленных генетическими факторами [104, 105], климатическими или почвенными условиями (например, поздними весенними заморозками), недостатком бора или цинка [77] и повреждением гербицидами, вызывающими деформацию листьев (2,4-Д) или пожелтение жилок (монурон-диурон). Но для окончательного диагноза требуется проведение указанных ниже опытов по передаче вируса: индексирование прививкой на лозу индикаторных сортов (особенно Vitis rupestris); анатомическое исследование для обнаружения трабекул у соответствующих сортов винограда (Кобер 5ВВ; Телец-кий 5С); механическая инокуляция травянистых хозяев. Симптомы, появляющиеся на Chenopodium quinoa, С. amaranticolor и Gomphrenа globosa, обычно помогают отличить короткоузлие от других вирусов, вызывающих симптомы кольцевой пятнистости и поражающих виноградные лозы. Серологические тесты с использованием экстрактов виноградных лоз или травянистых растений и соответствующих разведений иммунных сывороток к вирусам, вызывающим кольцевую пятнистость, а именно: черной кольцевой пятнистости томата, кольцевой пятнистости томата, мозаики резухи и короткоузлия винограда.
содержание .. 59 60 61 62 63 64 65 66 67 68 69 70 ..