содержание .. 1 2 3 4 5 6 7 8 9 10 ..
ПОКРЫТИЕ ПОВЕРХНОСТИ ИЗДЕЛИЙ ИЗ АЛЮМИНИЯ
Поверхность металлических предметов, находящихся на воздухе, не остаётся
без изменения. Новая только что изготовленная деталь, отшлифованная и
отполированная до блеска, постепенно тускнеет. На ней возникают
разрушенные участки, покрывающие её точно язвочки. Это делает враг
металла — кислород. Атомы этого элемента, содержащегося в воздухе,
присоединяются к атомам металла. Образовавшиеся соединения — окислы
металла — и лишают металлическую поверхность приданного ей блеска, всё
больше и больше разрушают деталь. Это разрушение металлов — потускнение
свинца, олова, зелё-ный налёт на меди, рыжая ржавчина на стали и железе
— уже давно известно человеку. Люди знают, что многие металлы подвержены
атакам кислорода, или, выражаясь языком науки,— химической коррозии. Не
свободен от неё и алюминий, но взаимодействие с кислородом происходит у
него по-своему.
Кусок алюминия на воздухе быстро покрывается тончайшей бледноголубой
плёнкой окисла, но, возникнув на поверхности, эта плёнка предохраняет
основную массу металла от дальнейшего разрушения. Как своеобразный
защитный панцырь, она, в отличие от ржавчины, не пропускает внутрь
металла атомы кислорода. Плёнка прочна, тверда и гибка. Она не отстаёт
даже в том случае, если деталь растягивать, сжимать, закручивать или
изгибать. Бледноголубой слой окиси алюминия не боится жары — он плавится
при температуре 2050°, в то время как чистому алюминию достаточно всего
лишь 660°, чтобы перейти в жидкое состояние.
В сухой атмосфере слой окиси хорошо защищает алюминий и его сплавы от
коррозии, оберегая их от соприкосновения с кислородом воздуха — этим
злейшим врагом железа и стали. Он не похож на ржавчину, которую, если
продолжить наше сравнение, можно назвать дырявой рубашкой, пропускающей
кислород внутрь железа.
Кроме химической коррозии бывает ещё коррозия электрохимическая, при
которой процесс разрушения идёт за счёт протекания электрического тока
от одной части металла к другой. Этот вид коррозии может появиться, если
на металл воздействовать каким-нибудь электролитом — раствором кислоты,
щёлочи или соли,— способным проводить электрический ток. А такое
воздействие можно встретить очень часто.
Атмосферный воздух, которым окружено большинство металлических изделий,
всегда влажен. Колебания температуры вызывают выпадение влага. Каплями
росы она покрывает все предметы. Эти капли, растворяя в себе водород,
сернистый газ, углекислоту, хлор и другие примеси воздуха, превращаются
в электролиты. Если к этому добавить, что многие части машин и
сооружений находятся подчас в грунте, морской воде и т. д., то
становится совершенно ясно, как велика опасность электрохимической
коррозии.
Что же происходит в электролите? Молекулы раствора
распадаются на ионы — атомы и группы атомов, несущих на себе
электрический заряд. Если в такой раствор погрузить две пластинки разных
металлов и соединить их проволокой, то через раствор начинает течь ток.
Ионы
переносят электрические заряды от одной металлической пластинки к
другой. Мы получим гальванический элемент (рис. 8, а) —один из
простейших источников электрического тока. Пластинки металлов — это
электроды элемента— анод и катод. Ток, порождаемый нашим элементом,
легко обнаружить, подключив к цепи измерительный прибор. В процессе
создания тока одна из пластин — анод—постепенно растворяется в
электролите.

Рис. 8. Схема гальванического элемента (а) и микроэлемента (б).

Рис. 9. Разрушение границ зёрен алюминия при электрохимической коррозии.
Изучая взаимодействие электролитов с металлами, учёные установили ещё одну особенность: достаточно погрузить в жидкость, проводящую ток, плохо очищенный металл, чтобы увидеть явления, подобные тем, которые появлялись при опускании в раствор двух металлических пластинок.
Секрет этого явления, обнаруженного более ста лет
назад, состоит в том, что в металле образуется множество микроскопически
маленьких гальванических элементов (рис. 8, б). Анод такого
микроэлемента — сам металл, а катод — частичка примеси. В течение
длительного времени эти микроэлементы производят отнюдь не
микроскопическую работу. Они заметно растворяют анод, то-есть
разъединяют зёрна металла. Так возникает электрохимическая коррозия. На
рис. 9 приведена структура алюминиевого сплава, поражённого
электрохимической коррозией. Здесь анодами являются примеси на границах
зёрен, а катодами — сами зёрна. Электрохимическое воздействие разрушило
их, и металл потерял свою прочность.
Отсюда ясно, что чем чище металл, тем менее опасно для него такое
разрушительное воздействие. И тут-то возникает противоречие. Чтобы
придать алюминию высокую
прочность и ряд других ценных свойств, учёные
создают разнообразные сплавы, но, с другой стороны, именно сплавы более
всего подвергаются коррозии.
Каков же выход из этого противоречия? Как находят его учёные?
Советские исследователи проводят большую работу по защите металлов от
коррозии. Выдающихся успехов в этой области добились академик В. А.
Кистяковский, члены-корреспонденты Академии наук СССР Г. В. Акимов и Н.
А. Изгары-шев. В научно-исследовательских институтах под их руководством
сотни научных работников ведут борьбу за продление жизни металлов и
сплавов.
Чистый алюминий обладает большей сопротивляемостью электрохимической
коррозии, чем сплавы. Поэтому его и используют для защиты менее стойких
сплавов с другими металлами и прежде всего дуралюмина. Для этого
пластины из дуралюмина перед прокаткой в лист обкладывают с обеих сторон
листами из чистейшего алюминия и затем пропускают через валки (рис. 10).
В результате подобной обработки на поверхности дуралюминового листа
остаётся тонкий слой из чистого алюминия, плотно сцепленный со сплавом;
и пока этот слой не разрушен, весь лист надёжно защищён от разъедания.
Но на этом не кончаются заботы о защите листа. После тщательного
обезжиривания — удаления с его поверхности частичек масла — лист на
несколько минут погружают в ванну с раствором крепкой серной кислоты. К
ванне подключается постоянный ток так, чтобы катодом была сама ванна, а
анодом — дуралюминовый лист. Происходит так называемый процесс
анодирования. Под воздействием электрического тока на листе возникает
защитная окисная плёнка окиси алюминия толщиной до 0,1 мм.
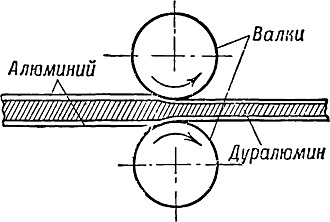
Рис. 10. Схема покрытия дуралюмина чистым алюминием.
Если эту плёнку рассмотреть в микроскоп, то при
большом увеличении в ней можно обнаружить огромное количество мельчайших
пор, более широких на поверхности и суженных в глубине (рис. 11). Пока
поры ничем не заполнены, металл подвержен опасным атакам кислорода.
Чтобы этого не случилось поры окисной плёнки тщательно наполняются
особыми минеральными
составами. В частности, широкое распространение получило так называемое
хроматное наполнение. В этом случае алюминиевые детали после
анодирования погружаются в ванну с раствором, содержащим соединение
калия с хромом. Молекулы этого соединения проникают в мельчайшие поры
плёнки и делают их пассивными к воздействию внешней среды.
Прикрытые своим кислородонепроницаемым панцы-рем, алюминий и его сплавы
превращаются в детали самолёта. И вот он стоит на взлётной дорожке
аэродрома. Сверкает серебро фюзеляжа и крыльев, резко откинутых назад,
не видно пропеллера. Это реактивный самолёт—машина больших скоростей.
Условия, в которых приходится летать таким самолётам, тяжелы. Снаружи —
40—50-градусный мороз высоких слоёв атмосферы, а внутри — некоторые
детали двигателя разогреваются до красного каления; их работа протекает
при температуре 700—800°.
История создания реактивного двигателя была борьбой за жаростойкие
сплавы, способные противостоять окислению при высоких температурах.
Обычные марки стали, нагретые до температуры 700—800°, не только теряют
прочность, но и быстро покрываются легко отскакивающей с их поверхности
хрупкой и ломкой окалиной. Ясно, что такая сталь не годится для
постройки жаровых труб реактивного самолёта. И здесь на выручку снова
пришёл крылатый металл. Стальные листы, из которых
изготовляются такие трубы, покрывают тонким слоем алюминия.
Проще всего это сделать методом напыления. Мощная воздушная струя из
специального аппарата-металлизатора (рис. 12) несёт мельчайшие капель-
ки расплавленного
алюминия. Ударяясь .
о поверхность стали,
они прочно пристают к ней и образуют тончайшую корочку.
Затем деталь подвергается нагреванию.
Под действием высокой температуры атомы алюминия проникают в сталь и
образуют с ней прочное химическое соединение. Жаростойкость поверхности
стали, насыщенной таким образом алюминием и покрытой плёнкой его окиси
при температуре 600—850° в 20 раз больше, чем у обычной стали.

Рис. 11. Строение защитной плёнки на анодированном алюминии.

Рис. 12. Металлизатор для покрытия стали алюминием.
содержание .. 1 2 3 4 5 6 7 8 9 10 ..