содержание .. 10 11 12 13 14 15 16 17 18 19 20 ..
§ 2.
Природный углеводородный газ
Углеводородный газ находится в недрах Земли в виде самостоятельных скоплений, образуя чисто газовые залежи или газовые шапки (свободный газ), а также в растворенном состоянии в нефти или воде.
Химический, состав природных углеводородных газов
Горючий газ представляет собой смесь предельных углеводородов (С„Н2„+2): метана (СН4), этана (С2Н6), пропана (С3Н8) и бутана (С4Н10). Нередко в составе газа присутствуют более тяжелые углеводороды: пентан (С5Н12), а также гексан (С6Н14) и гептан (С7Н16).
Газы, содержащие более 100 г тяжелых углеводородов (пентана, гексана и гептана) в 1 м3, относят к «жирным», менее 100 г — к «сухим».
Пентан и высшие входят в состав газов конденсатных залежей. При снижении температуры и давления из газов этих залежей выделяется жидкая углеводородная фаза — конденсат. Сырой конденсат состоит из жидких при стандартных условиях (0,1 МПа и 20 °С) углеводородов, в которых растворено определенное количество газообразных углеводородов. Стабильный конденсат состоит только из жидких при стандартных условиях углеводородов, т. е. пентанов и высших. Поэтому стабильный конденсат получают из сырого конденсата путем его дегазации и дебутани-зации.
Углеводородные газы обычно могут содержать углекислый газ, азот, сероводород и небольшое количество редких газов (гелия, аргона, неона). Газы с высоким содержанием H2S являются сырьем для получения почти чистой серы.
Физические свойства природных углеводородных газов
Плотность газа — это масса 1 м3 газа при О °С и атмосферном давлении. Размерность ее кг/м3. Обычно пользуются относительной плотностью газа. Относительная плотность (по воздуху) естественных газов изменяется от 0,6, когда газ в основном состоит из метана, до 2 и выше, когда он содержит значительное количество тяжелых углеводородов.
Вязкость углеводородных газов незначительная. Вязкость сухого углеводородного газа при О °С 13-Ю"6 Па-с, а воздуха — 17-10"* Па-с. С увеличением температуры вязкость газа и воздуха увеличивается.
Законы газового состояния, известные из физики, справедливы для идеальных газов. Для углеводородных газов они требуют определенных корректив. Чем больше плотность газа и чем выше давление, тем больше отклонение законов для реальных газов от законов для идеальных газов.
Коэффициент сжимаемости газа — отношение объемов реального и идеального газов при одинаковых условиях Z = = Vp/Vm, где Vp — объем 1 кг газа при данных давлении и температуре; FH — объем 1 кг идеального газа при тех же условиях.
Коэффициент сжимаемости Z определяет и величину отношения объемов реального газа при пластовых и стандартных условиях. 96

При этом он непосредственно зависит от величин пластовых давления (в Па) и температуры (в К) — Z = 0,00289 (рпл/Та11) X X (Vaa/Vor).
Величину коэффициента сжимаемости чаще всего определяют по экспериментальным кривым (рис. 32). На рис. 32 значения этого коэффициента даны в зависимости от приведенных псевдокритических давлений и температур. Псевдокритическими давлением и температурой называют суммы средних взвешенных критических значений соответственно давлений и температур отдельных углеводородов, из которых состоит смесь.
Критической называется такая температура, выше которой газ не может превратиться в жидкость, критическим называется давление, которое соответствует точке перехода газа в жидкость (табл. 2). Под приведенными псевдокритическими давлением и температурой понимают отношение рабочих абсолютных давлений и температур соответственно к псевдокритическим значениям давления и температуры для данного состава газа.
Пример расчета псевдокритических давлений и температур приведен в табл. 3. Зная пластовое давление и температуру, можно определить приведенные псевдокритические давление ря и температуру TR по формулам: pR = рал/рг; TR = ТПП/ТГ, где Рпл — пластовое давление, МПа; Тпл — абсолютная температура газовой смеси в пластовых условиях, равная Т0 + ^пл (Т0 = 273 К, ^Пл — пластовая температура, °С); рг — псевдокри-
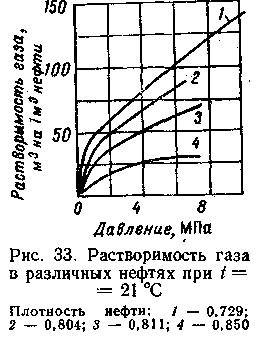
Таблица 2
Значения критических давлений и температур
Компонент |
Молекулярная масса |
Масса 1 м3 газа, кг |
Критическая температура 'кр- °С . |
Критическое абсолютное давление рс, МПа |
Плотность по воздуху |
Метай |
16 |
0,714 |
—82,5 |
4,58 |
0,554 |
Этан |
30 |
1,35 |
+32,28 |
4,82 |
1,038 |
Пропан |
44 |
1,97 |
+96,78 |
4,20 |
1,522 |
Изобутан |
58 |
2,85 |
— 134 |
3,64 |
2,006 |
н-Бутан |
58 |
2,85 |
-452 |
3,75 |
2,006 |
Изопентан |
75 |
3,22 |
— 187,78 |
3,29 |
2,490 |
«-Пентан |
72 |
3,22 |
+ 197 |
3,30 |
2,490 |
Гексан |
86 |
3,81 |
•' +234,78 |
2,99 |
2,974 |
Гептан |
100 |
4,48 |
+267 |
2,70 |
3,459 |
Азот |
28 |
1,25 |
—147 |
3,35 |
0,967 |
Углекислый газ |
44 |
1,964 |
—31,1 |
7,29 |
1,514 |
Примечание. Физические свойства газов даны при р = 0,1 МПа и t = 15,5 °С'
тическое давление, МПа; Тг — псевдокритическая температура, К. Согласно закону Генри, растворимость газа в жидкости пропорциональна давлению. Углеводородные газы мало отклоняются от закона Генри при сравнительно низких давлениях. При высоких давлениях наблюдается взаимное растворение газа в жидкости и жидкости в газе. Коэффициент растворимости для углеводородных газов обычно составляет 0,3—2.
Таблица 3
Пример расчета псевдокритических давлений и температур
Сухие углеводородные газы в большей степени подчиняются закону Генри, чем жирные. Для сухих газов коэффициент растворимости в пределах обычных пластовых давлений остается постоянным, для жирных газов он меняется вместе с давлением. С повышением температуры способность газа растворяться в жидкости уменьшается. При приближении к критическому давлению перехода газа в жидкую фазу закон Генри неприменим.
НаТрастворимость газа в нефти влияет ее плотность В более тяжелых неф-тях растворимость его меньше, чем в легких (рис. 33). Это объясняется большей химической близостью газа к легкой нефти. Поэтому жирные газы лучше растворяются в нефти.
Количество растворенного в нефти газа определяется при изучении проб нефти, отобранных из скважины глубинным пробо-отборником^]при пластовом давлении.
Содержание газа в глубинной пробе нефти определяется при контактном дегазировании, когда газ, выделяющийся из раствора, остается в контакте с жидкостью, или при дифференциальном дегазировании, когда весь выделяющийся газ периодически отводится из системы. Наиболее полное дегазирование нефти происходит при контактном -способе.
Количество газа, растворенного в 1 т пластовой нефти, называется растворимостью газа в нефти или газосодержанием,, а количество добытого газа, приходящегося на 1 т добытой нефти, называется газовым фактором.
Компонент |
Содержание компонента в смеси у, % |
Критические абсолютные |
Псевдокритические |
||
Давление рс, МПа |
Температура тс = |
Давление УРС |
Температура т УТ« |
||
= го+'кр' К |
»г - 100 ' МПа |
'г~ 100 ' К |
|||
Метан Этан Пропан н-Бутан н-Пентан |
92,6 1,6 0,4 2,2 3,2 |
4,58 4,82 4,20 3,75 3,30 |
190,5 305,28 369,78 425,0 470,2 |
4,240 0,077 0,017 0,082 0,105 |
176,40 4,88 1,48 9,35 15,04 |
Сумма |
100 |
4,521 |
207,15 |
||
содержание .. 10 11 12 13 14 15 16 17 18 19 20 ..